

| 金属クラスター表面に吸着した分子の解離吸着への活性化エネルギーの実測 (科学研究費助成事業(基盤研究(C)) |
ページ製作中 暫定公開
| 化学反応の基本 化学反応の本質は結合の組み換えです。分子と分子(あるいは原子)が出会い互いに電子を共有しあって結合を作り新し分子となったり、分子の結合が切れての一部が離れて行ったりするということが化学反応では起こっています。 しかしながら、分子と分子が出会えば必ず結合を作るのかかといえばそうではなく、何もしないのに突然分子の一部が離れていくということも普通は起こりません。 分子の一部が離れていくためには(解離反応) 熱エネルギーなどで結合を切り離す必要があります。そのために必要なエネルギーを結合解離エネルギーと呼びます。このエネルギーがどのくらいであるのかは比較的簡単に調べることが出来ます。例えば、気体の場合は、分子などの質量を知ることができる質量分析装置でどの大きさの分子がそこにあるのかを調べながら温度を上げていき、その時に解離した分子がどの出来ているのかを調べると結合解離エネルギーを知ることがが出来ます。 では、分子と分子が出会ったときに何が起きるのかですが、分子の多くは分子どうしが出会っただけで直ぐに結合を作ることはありません(イオンどうしの反応など例外はあります)。もしも分子どうしが出会っただけで反応してしまうと身の回りの有機分子(例えば、紙とかプラスチックなど)のほとんどは空気中の酸素分子と反応して直ぐに燃え尽きて二酸化炭素と水になってしまいます。なぜなら二酸化炭素や水は極めて安定な分子だからです。 それではなぜ反応しないかといえば、分子内の原子の間で既に結合を作っていて結合の手が余っていない状態になっているためです(高校化学でも習うオクテット則などが関係しています)。それでも、分子どうしを無理やり近づけると、分子の間に新しい結合ができ、その代わりにそれぞれの分子内の結合が少し緩んだ状態が一瞬だけ出来ます(これを遷移状態と呼びます)。そして、さらに押し付けると一時的に二つの分子が合わさった状態になります(これを中間体と呼びます。この状態がない反応もあります)。そして、別の遷移状態を通って、新しい二つの分子に分かれていきます。ここに出てきた遷移状態がどれだけ不安定であるかを表すものが活性化エネルギーです。このエネルギーの高さが分子どうしが出会ったときに反応するのか、しないのかを決める重要な要因の一つになります。 |
| 触媒とは 触媒とは、それ自身は(反応前後で)変化しないが加えることで化学反応を速める物質とされています。触媒には多くの種類があり、応を速める仕組みも様々です。化学的にどんな役割をしているかを簡潔に言えば、ある反応に対して活性化エネルギーの低い反応経路を作り出す物質が触媒となります。触媒は反応ごとに異なっていて、ある反応に対して触媒として働いても、他の反応に対しては触媒として働かないことがほとんどです。その理由は後述しますが、そのため様々な反応に対して最適な触媒を作り出す必要があります。逆に言えば適切な触媒を使えば余計な反応を起こさずに目的の物質のみを作り出すことも可能になります。 図1に触媒が関与する反応の概念図を示しました。例として分子ABが分子Cと反応して分子Aと分子Bに変わる反応を取り上げています(A, B, Cは分子中の原子や部分構造(化学では「基」ともいう)と考えてください)まず、気相中での直接反応では、一般的には分子ABと分子Cが近づいていくと反発し合います。反発に逆らってさらに近づけると反発のエネルギーが高くなっていきます。そして、ある点で分子ABと分子Cの間に結合ができ始めて、中間体ABCが生成します。そして、AとBの間の結合が切れ始めて最終的に分子Aと分子BCになります。このときA, B, Cの位置により蓄えられているエネルギーが曲線で示されているものです(このエネルギーをポテンシャルエネルギーと呼びます)。イメージとしては滑り台に載ったものを下から押し上げていくようなものだと考えることもできます。このポテンシャルエネルギーの山を登っていくための原動力は運動エネルギーです。温度が高いほど分子は早く動き回るので運動エネルギーも大きくなり山を乗越えやすくなります。 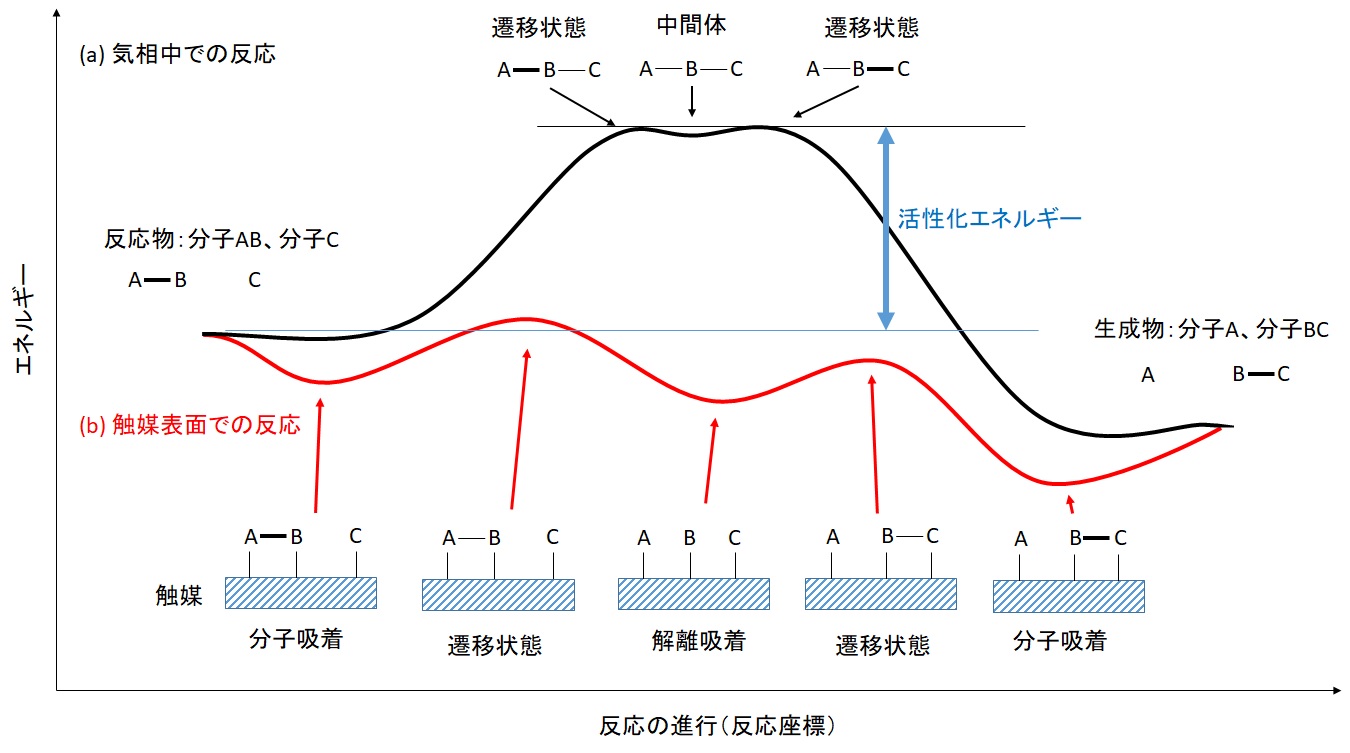 図1 置換反応での気相反応と触媒反応の反応機構とポテンシャルエネルギー 次に触媒があるときを考えます。図1に赤い線で示した曲線は触媒があるときのポテンシャルエネルギーです。ここでは固体の触媒の表面で反応が進む場合を考えます(このような触媒を不均一触媒といいます)。まず、分子ABと分子Bが触媒の表面に吸着します(分子吸着)。このとき分子と触媒(の原子)の間に結合が出来てエネルギー的に安定化します。さらにこのとき、分子ABのAとBの間の結合が弱くなります。そして熱エネルギーなどにより遷移状態を超えて、AとBが解離して(離れて)吸着した状態ができます(解離吸着)。次のステップとしてBとCの間に結合ができ始めて別の遷移状態を超えて分子BCが生成し、その後、触媒表面から脱離していきます。遷移状態の活性化エネルギーが低いので気相中での反応よりもより低温で反応が進むようになります。遷移状態の活性化エネルギーが低くなる理由も様々ですが、触媒表面と結合するとこで電子がその結合に移動しその代わりに分子内(AとB)の結合が弱くなったり、解離して生成したAやBが安定化されたりするなどがあります。この説明を読んで「いや、必ずしも安定化するとは限らないのでは?」と思う人もいると思います。そのように考えるのもっともですが、安定化するようなものが触媒として作用するので安定化しない物質は触媒として作用しません。また、安定化し過ぎると触媒表面から分子が脱離することが出来なくなるので、そのような物質も触媒としては働きません。結構複雑な事情があるのです。それゆえに奥深い研究なのですが。 |
| |
| 金属クラスターとは 化学の分野では、クラスターとは原子や分子が少数個(いろいろな意見があるが数個から数千個*1)集まったもののことをいいます。金属クラスターは金属原子が集まってクラスターとなったものを指します。金属やその酸化物は電子状態や表面の構造が複雑であり触媒として働くものが多数知られています。一方で、クラスターは原子ともバルク(目に見えるような巨視的物体のことをいう)とも異なる性質を持つことが知られています。原子といえば、例えば炎色反応を示したり、蛍光灯の中で紫外線を出したりしていますし、バルクの金属はたいていは金属光沢を示していて熱すると赤く光ったりします。このように原子とバルクでは全く異なる性質を示しているわけですが、それで何個でその性質が変わるのかという疑問がわいてきませんか? 実際には、そのどちらでも無い性質を示す原子数の範囲がありそれらのうちで少ない領域を金属クラスターとしています。多い方の領域はナノ粒子と呼ばれていて、この領域でもまだバルクとは異なる性質を持つとされています。このように、原子ともバルクとも異なる性質を持つのでさらに面白い性質(高効率な触媒や予想もしていない性質)を持つ金属クラスターがないか多くの研究者が探しています。 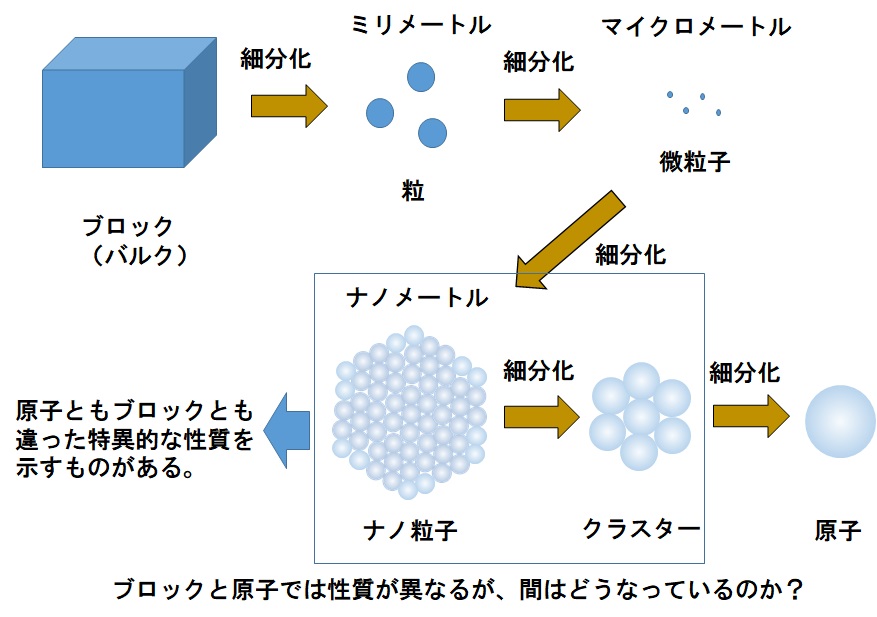 図2 クラスターとナノ粒子とは これらに加えて、原子が少数個であることから精密な反応の観測が可能であるので、金属クラスターをバルクの表面の活性点のモデルとして研究対象とするという考え方もあります。バルクの場合では表面分光法(赤外分光、電子分光など)により触媒表面にある分子の構造や触媒の電子状態をることができ、また、脱離してくる分子を質量分析法で同定することで反応機構を知ることが出来ます。しかしながら、様々なサイト(吸着しやすい場所)に吸着した分子の吸収バンドが重なるなどするために得られる情報は複雑なものになります。一方で、金属クラスターの場合には金属原子数が少ないためにサイトの数も少なく、また、計算機などによる吸収バンドの位置の予測と組み合わせることでどのサイトに分子が吸着しているのかなどをより詳細に知ることができます。それにより、反応機構を具体的に推測できます。 *1 数千個は多いと感じる人もいるかと思うが、およそ10京個くらい原子が集まると肉眼で見えるようになるのではないかと考えられるので数千個ではまだまだ少数といえる(原子量、アボガドロ定数を知っていれば概算可能)。 |
| これまでの研究 金属クラスターについては数多くの研究がありここで全てを紹介することは出来ないので、この研究課題に直接関係した私が所属していたグループの研究を簡単に紹介します。 自動車(ガソリンエンジン)の排気ガス中の有害物質を分解するために三元触媒というものが使われており、その中にロジウムが使われています。そこで、ロジウムのクラスター上での一酸化窒素(有害物質のひとつ)の分解反応について研究を進めています。研究手法としては、ヘリウムガス中*1でクラスターを生成し、目的ガスと反応させた後、加熱してから真空中に放出し、質量分析器でクラスターの質量を調べて、加熱によって質量がどのように変化したのかを測定することでどのような反応が起きているのか調べるというものです。例えば、以下のような反応が起きたとします*2。 Rh6 + 2NO → Rh6(NO)2 → Rh6O2 + N2 これはロジウム原子6個からなるクラスターに一酸化窒素が反応して吸着した後、ロジウム酸化物クラスターと窒素分子が生成する反応を示しています。ロジウムと一酸化窒素の結合エネルギーは比較的大きいため室温ではロジウムクラスターに一酸化窒素が吸着したクラスターが観測されます。そして、約600℃に加熱すると窒素分子の脱離が観測されます。このことから、加熱によって窒素分子が脱離したのではないかと考えることが出来ますが、実際にはそうではないと考えられます。窒素分子は化学的にはそれほど活性ではなく金属表面にも吸着しにくいからです。そうすると、室温ではどこで反応が止まっているのかを調べる必要が出てきます*3。上の反応をさらに詳しく考えてみると次のような段階的な反応を考えることができます。括弧内は分子として存在していることを示します。 Rh6 + 2NO → Rh6(NO)2 → Rh6(NO)NO → Rh6NONO → Rh6OO(N2) → Rh6O2 + N2 この式は、分子として一酸化窒素がロジウムクラスターに吸着し、その後、一分子ずつ一酸化窒素が解離して酸素原子、窒素原子が吸着した状態になり、さらに窒素原子どうしが結合して窒素分子になり、最後に窒素分子が脱離していくという反応式として表されています。複数のステップが同時に起こるということもあるかもしれませんが、ひとまず分けて考えます。 それでは、どこで反応が止まっているのかはどうすればわかるでしょうか? 質量分析法では分子脱離などを伴わない反応は観測できません。そこで、分光法の出番です。分光法としては一般的には赤外分光、紫外可視分光、核磁気共鳴、光電子分光などがあります。この中で、赤外分光は分子の構造に敏感であるので材料の評価などでよく使われています。赤外分光法では一般的には赤外線の吸収による光強度の減少を測定する赤外吸収分光がおこなわれますが、金属クラスターは非常に量が少ないことなどによって、赤外吸収分光は難しいのです。そこで、赤外線の光をクラスターに吸収させてエネルギーを与え、そのエネルギーによって分子を脱離させ、質量分析によって検出する赤外解離分光がおこなわれます。 ロジウムクラスター(Rh6+)に一酸化窒素を吸着させた複合体の構造を赤外解離分光で調べたところ一酸化窒素はそのほとんどが分子のまま吸着していることがわかりました*4。したがって、最初のステップで止まってしまっていたことになります。なぜ、進まないのかを調べるために量子化学計算をおこなって理論的に予測してみました。その結果、解離反応の活性化エネルギーが高いことがわかりました。原因がわかったので、この高さを低くするにはどのようにすればよいかと考えながら研究進めています。一方で、この活性化エネルギーは正しいのかという疑問も生じてきました。皆さんの中にはコンピューターを使った予測は常に正しいとお思いの方もいらっしかと思いますが、計算には間違いはないかもしれませんが、金属のように電子が多いものの精密な計算はまだまだ難しいというのが実情です。さらにそれらが複数集まった金属クラスターではさらに難しくなります。さらにその上で分子が解離する様子を予測するのはさらにさらに難しくなります。そのようなわけで、計算結果が正しいのかを実験的に測定する方法の開発を試みました。 *1 余計な反応をおこさないようにするために、化学的に不活性なヘリウムガス中で微量の目的ガスとだけ反応させる。 *2 質量分析の都合上、イオンである必要があるので実際には正電荷を持つクラスターを対象としている。この反応の詳細については論文 The Journal of Physical Chemistry A, 119, 8461(2015) を参照してください。 *3 理由を調べて理解し、ひとつひとつ改善していくことが科学技術の発展には不可欠です。やみくもにやっていたのでは途方もない時間がかかってしまいます。もちろん、最近発展しているマテリアルインフォマティクスのような技術も有用です。どちらも一長一短があるので併用していく必要があると考えます。 *4 一酸化窒素はN-O伸縮振動による赤外線吸収を持つため一酸化窒素分子が存在するのかしないのかがはっきりとわかります。詳細については論文 The Journal of Physical Chemistry C, 121, 27417(2017) を参照してください。 |
| 活性化エネルギーの実測 |
どのようにして調べるのか?
※本ページは一般の皆様への研究内容の紹介のために私費により制作、公開されています。
内容については制作者の個人的見解の部分もあり関係者、関係団体の総意ではありません。